発表のポイント
- 生体の多重イメージング法として注目されるラマン標識イメージングにおいて、光の回折限界を越える高い空間分解能でイメージングを行うことに成功しました。
- ラマン応答を光照射により変化させることのできる光スイッチングラマンプローブ分子を新規設計するとともに、紫外光・可視ドーナツビーム・2色近赤外パルスを同時照射する光学系を用いて細胞の超解像イメージングを実証しました。
- 今後、ラマンプローブの多色展開を行い、超多重・超解像イメージング技術に発展させることで、生体内の複数種の構成要素の微細構造を観察することが可能となり、生命や病気の仕組みの解明などにつながることが期待されます。
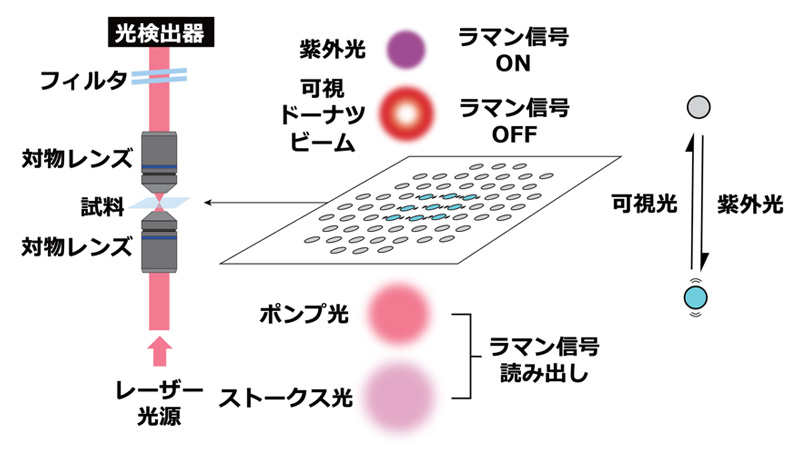
ラマンプローブによる超解像イメージング(RESORT)法の模式図
発表概要
東京大学先端科学技術研究センターの小関泰之教授(研究当時:同大学大学院工学系研究科電気系工学専攻)と同大学大学院工学系研究科電気系工学専攻の寿景文大学院生(研究当時)、東京工業大学 生命理工学院の神谷真子教授ら、東京大学大学院薬学系研究科の駒沢歩弥大学院生(研究当時)ら、同大学大学院工学系研究科電気系工学専攻の三田吉郎教授と安永竣助教(研究当時:特任研究員)らの研究チームは、光スイッチングの可能なラマンプローブ(注1)による超解像イメージング(注2)に成功しました。
光を用いて試料の分子振動を検出するラマン顕微法(注3)は、蛍光法と比べて多重検出能に優れており、一度に複数の標的を可視化できるイメージング手法として注目を集めています。しかし、その空間分解能は回折限界(光の波長程度)に制限されており、生体内の微細構造を観察する上での障壁となっていました。
本研究では、光でラマン信号を制御可能な光スイッチングラマンプローブを用いることで、ラマン顕微法による超解像イメージングを実現しました(図1)。まず、信号強度の高い光スイッチングラマンプローブDAE620を開発し、この分子に微弱な紫外線あるいは可視光を照射することでラマン信号をON/OFFできること、また、この光スイッチング動作は細胞中やショウジョウバエ組織中でも可能であることを確認しました。さらに、この分子で細胞小器官を染色し、紫外光と可視光ドーナツビームを照射しながら誘導ラマン散乱(SRS)顕微法(注4)によるイメージングを行うことで、回折限界を越える空間分解能を実現できることを実証しました。今後、光スイッチングラマンプローブを多色化し、超多色・超解像イメージングを実現することができれば、生体内の複数種の構成要素の微細構造を観察することが可能となり、生命や病気の仕組みの解明などにつながることが期待されます。
本研究成果は、米国東部夏時間6月16日付の「Science Advances」に掲載されました。

図1:ラマンプローブによる超解像イメージング(RESORT)法の模式図
発表内容
研究の背景
生体内では様々な微細構造を有する生体分子や小器官などが複雑に相互作用し、生命活動を維持していると考えられており、その観察技術の開発が求められています。超解像顕微鏡は、光学顕微鏡の回折限界を克服し、ナノメートルスケールの空間分解能で生体内の細胞内構造を観察することを実現しました。近年では多色超解像蛍光イメージング技術が開発されていますが、蛍光は波長帯域が広いため、分離検出可能な色数が制限されます。一方、分子振動を反映するラマン散乱は、蛍光よりも50倍程度狭い線幅を持つスペクトル特性を有し、多重検出能に優れます。ラマン散乱を検出するラマン顕微鏡を用いて超解像イメージングを実現できれば、超多色・超解像イメージングの実現に有利と考えられます。しかし、従来の超解像ラマン顕微法は高強度光の照射を必要とすることから、試料の光損傷といった問題や、複雑な光制御を必要とするなどの課題がありました。
研究の内容
本研究では、光スイッチングラマンプローブを用いる新しい超解像イメージング手法であるRESORT(REversible Saturable Optical Raman Transition)法を開発しました。本手法では、高速ラマンイメージング法として知られるSRS顕微法において、微弱な紫外光と可視ドーナツビームを導入することで超解像イメージングを実現します。RESORT法の実証のために、高いSRS信号強度を有し、光照射でラマン信号をON/OFFできる新しい光スイッチングラマンプローブDAE620を開発し、その優れた光スイッチング特性を確認しました。さらに、細胞中のミトコンドリアを染色可能なDAE620-mitoを合成し、ミトコンドリアの超解像イメージングを行いました。図2に示すように、SRSイメージングでは分解できなかった構造をRESORTイメージングで分離して観察することに成功しました。空間分解能は150 nm程度と見積もられます。さらに、テスト試料を用いて空間分解能を検証したところ、可視ドーナツビームの強度を高めるとともに空間分解能が100 nm程度まで向上できることがわかりました。
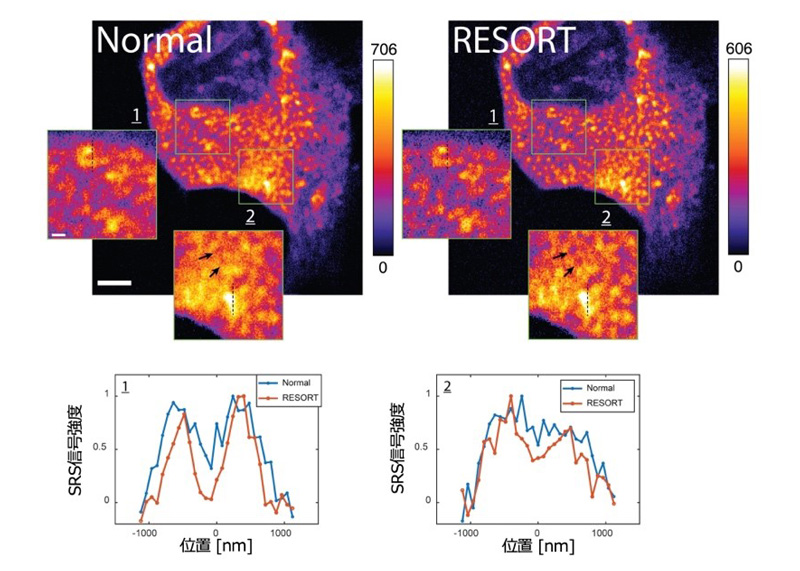
図2:(上)細胞内ミトコンドリアのRESORT画像。(下)画像中の点線部のクロスセクション。 通常のSRS画像(Normal)では分解できなかった構造がRESORTイメージングでは分解されて観察される。
今後の展望
今後、光スイッチングラマンプローブの多色展開を行い、超多色RESORT法を実現することができれば、超多色・超解像イメージングが実現し、従来手法では観察の難しかった複雑かつ微細な生体内の構造を明らかにすることができ、生命の仕組みや疾病の機構の解明などにつながる新しい知見につながることが期待されます。
関連のプレスリリース
- 「酵素発現領域を染め分ける高感度ラマンプローブの開発 -ヘテロな生体組織での多重酵素活性検出へ向けて-」(2023/4/19)
https://www.t.u-tokyo.ac.jp/press/pr2023-04-19-001 - 「複数酵素活性を同時に可視化できる activatable 型ラマンプローブの開発」(2020/11/25)
https://www.t.u-tokyo.ac.jp/press/foe/press/setnws_202011251052458474974626.html
発表者
東京大学
- 先端科学技術研究センター 光量子イメージング分野
小関 泰之(教授)<兼務:東京大学大学院工学系研究科 電気系工学専攻(教授)> - 大学院工学系研究科 電気系工学専攻
寿 景文(博士課程:研究当時)
三田 吉郎(教授)
安永 竣(助教)(特任研究員:研究当時) - 大学院薬学系研究科 薬科学専攻
駒沢 歩弥(修士課程:研究当時)
東京工業大学 生命理工学院 生命理工学系
- 神谷 真子(教授)
論文情報
- 雑誌:
- Science Advances
- 題名:
- Super-resolution vibrational imaging based on photoswitchable Raman probe
- 著者:
- Jingwen Shou, Ayumi Komazawa, Yuusaku Wachi, Minoru Kawatani, Hiroyoshi Fujioka, Spencer John Spratt, Takaha Mizuguchi, Kenichi Oguchi, Hikaru Akaboshi, Fumiaki Obata, Ryo Tachibana, Shun Yasunaga, Yoshio Mita, Yoshihiro Misawa, Ryosuke Kojima, Yasuteru Urano, Mako Kamiya and Yasuyuki Ozeki
- DOI:
- 10.1126/sciadv.ade9118
- URL:
- http://www.science.org/doi/10.1126/sciadv.ade9118
研究助成
本研究は、科研費JP20H05724、JP20H05725、JP20H05726、JP19K22242、JP20H02650、JP22H02193、JP19J22546、JSPS研究拠点形成事業、CREST JPMJCR1872、中谷医工計測技術振興財団、内藤記念科学振興財団、三菱財団、第一三共生命科学研究振興財団、文科省ARIM JPMXP1222UT1055、文科省Q-LEAP JPMXS0118067246の支援を受けて実施されました。
用語解説
- (注1)ラマンプローブ
生体分子とは異なる特異な分子振動を持つ分子であり、これを用いて生体の標的部位を染色し、そのラマン散乱を検出することで標的を検出することができる。ラマン散乱の狭帯域性を活用し、さまざまな分子振動周波数を持つラマンプローブ群を用いた生体分子の多重検出技術が近年盛んに研究されている。 - (注2)超解像イメージング
従来の光学顕微鏡の空間分解能は光の波長程度に制限され、このことは回折限界として知られている。超解像イメージングはこの回折限界を越える空間分解能を実現するものであり、これまでにさまざまな方式が提案され、2014年のノーベル化学賞の対象にもなっている。 - (注3)ラマン顕微法
顕微鏡下で試料からのラマン散乱を検出し、試料を構成する分子の分子振動スペクトルを計測することでイメージングを行う方法。 - (注4)誘導ラマン散乱(SRS)顕微法
2色の光パルスを用いることでラマン散乱を高速・高感度に検出してイメージングを行う方法。従来のラマン顕微法は計測に数十分程度を要していたのに対し、SRSを用いることで計測時間を秒オーダーに短縮できた。
研究に関する問合せ
東京大学先端科学技術研究センター 光量子イメージング分野
教授 小関 泰之(おぜき やすゆき)
原文URL:https://www.rcast.u-tokyo.ac.jp/ja/news/release/20230617.html
