理化学研究所
東京大学
京都大学
東京医科歯科大学、自治医科大学、科学技術振興機構
理化学研究所(理研)開拓研究本部渡邉分子生理学研究室の渡邉力也主任研究員、篠田肇研究員、東京大学先端科学技術研究センターの西増弘志教授、同大学大学院理学系研究科の濡木理教授、京都大学医生物学研究所の野田岳志教授、東京医科歯科大学大学院医歯学総合研究科の武内寛明准教授、自治医科大学の崔龍洙教授らの共同研究グループは、新型コロナウイルス(SARS-CoV-2)由来のウイルスRNAを「1分子」レベルで識別し、迅速に検出できる全自動検出装置の開発に成功しました。
本研究成果は、新型コロナウイルス感染症(COVID-19)などの超高感度・迅速診断装置の開発を含む、次世代の感染症診断法の核心技術として社会実装されるものと期待できます。
今回、共同研究グループは、2021年に開発した世界最速のSARS-CoV-2検出法「SATORI法[1]」を基盤とし、感度・精度を大幅に向上させた全自動検出装置「automated platform on SATORI;opn-SATORI装置」を開発しました。opn-SATORI装置を用いると、9分以内でウイルスRNAを1個ずつ識別し、検体中の個数を全自動で定量することができます。検出感度は1.4コピー/マイクロリットル(1,000分の1mL)であり、PCR検査法[2]と同等で、COVID-19の診断に十分です。また、1塩基単位の変異を識別できる技術も併せて開発し、臨床検体を用いた検証実験では、陽性判定および変異株判定において、98%以上の正解率を達成しました。さらに、ランニングコストは1検査あたり2ドル程度までコストダウンに成功し、PCR検査法や抗原検査法と同等になりました。
本研究は、オンライン科学雑誌『Communications Biology』(5月26日付:日本時間5月26日)に掲載されました。

opn-SATORI装置
【背景】
現在、新型コロナウイルス感染症(COVID-19)の感染診断では、主にタンパク質抗原を検出する方法(抗原検査法)とウイルスRNAを増幅して検出する方法(PCR検査法[2])が利用されており、それぞれスクリーニング、確定診断など用途に応じて使い分けされています。感染が疑われる場合、抗原検査法を用いたスクリーニングが行われます。抗原検査法は30分程度と迅速かつ簡便にウイルスを検出できるため、スクリーニングには適していますが、検出感度や特異度[3]の低さに起因する検出エラーの多さが問題となっています。
一方、次のステージの確定診断として用いられているPCR検査法では、専門的な技術や装置を用いて検体からRNAを精製し、さらに増幅の過程を経て検出に至ります。PCR検査法は感度が高く、確定診断に適していますが、検出の前処理に最短で1時間程度がかかること、また増幅に起因する検出エラーも発生することから、大量の検体を迅速に解析し、診断につなげることが困難です。そのため、PCR検査法の「感度の高さ」、抗原検査法の「迅速・簡便さ」を両立させた新しいウイルス検出法の開発が急務とされてきました。
このような背景を受け、2021年、共同研究グループは世界最速の新型コロナウイルスの検出法「SATORI法」を開発しました注1)。SATORI法は、渡邉力也主任研究員のグループが専門とする「マイクロチップを利用した酵素反応の1分子検出技術」と西増弘志教授のグループが専門とする「核酸切断酵素CRISPR-Cas13a[4]」に関する先進技術を融合させたものであり、検体中の標的ウイルスRNAの有無を短時間に判定できる革新性を持っていました(図1)。
しかしSATORI法の検出感度はPCR検査法より低く、また変異株の判定ができないなどの課題を抱えていました。さらに、社会実装を想定すると、臨床現場での効率的な運用を実現するため、サンプル調製から陽性判定に至るまでの感染診断プロセスの全自動化が必要不可欠であり、SATORI法の要素技術の改善ならびに全自動化装置の開発が期待されていました。
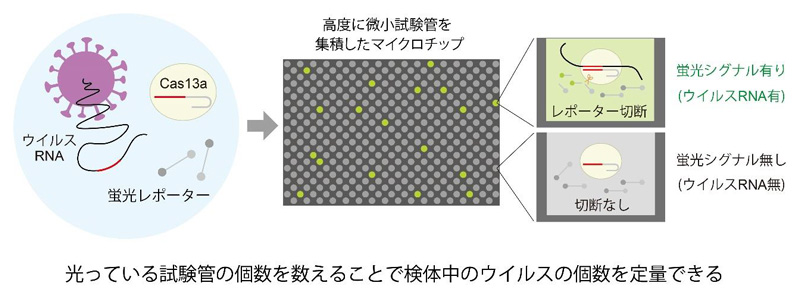
図1 独自の新型コロナウイルスの世界最速検出技術(SATORI法) 核酸切断酵素Cas13aと蛍光レポーター、検体のウイルスRNAを混ぜると、特異的にウイルスRNAとCas13aの複合体が形成される。複合体が形成されるとCas13aの酵素活性がオンとなり、蛍光基と消光基がつながった蛍光レポーターが切断される。これをマイクロチップアレイに小分けにして封入すると、ウイルスRNAが存在する微小試験管だけ蛍光シグナルが1分以内に上昇する。マイクロチップの蛍光シグナルの有無を二値化し、そのデジタル信号からシグナル有りの微小試験管の個数をカウントする。微小試験管内にウイルスRNAは1個だけ存在するため、カウントされる試験管の個数はサンプル中のウイルスRNAの個数に相当する。
注1 )2021年4月19日プレスリリース「新型コロナウイルスの超高感度・世界最速検出技術を開発」
【研究手法と成果】
今回、共同研究グループは、2021年に開発した世界最速の新型コロナウイルス検出法「SATORI法」の感度・精度を大幅に向上させた全自動検出装置の開発に成功し、その装置を「automated platform on SATORI;opn-SATORI装置」と名付けました(図2)。
opn-SATORI装置は、従来のSATORI法の要素技術を徹底的に改善するとともに、COVID-19感染診断検査のうち、サンプルの調製、顕微鏡測定、ウイルスの個数定量、陽性/変異株判定の全ての工程を全自動化しました。要素技術の詳細な改善点は以下の通りです。
1) SATORI法のマニュアル操作を自動化すべく、最適な自動分注ロボットと解析プログラムを開発。
2) 新種のCRISPR-Cas13a(嫌気性グラム陰性桿菌Leptotrichia trevisanii由来)を用いることにより、検出感度を30倍程度改善。
3) 磁気ビーズ[5]を用いたサンプル濃縮技術を開発し、検出感度を46倍程度改善(2と3を組み合わせて、検出感度が約1,400倍向上)。
4) Cas13aのウイルス識別能を左右するガイドRNA配列を最適設計し、変異株に特徴的な1塩基変異の識別技術を開発(陽性判定とともに、オミクロン株などの既知の変異株の判定が可能)。
5) マイクロチップ、試薬などの材料・製造プロセスを一から再選定し、ランニングコストを1検査あたり約2ドル(従来法の約4分の1)までコストダウン。
opn-SATORI装置を用いると、9分以内でウイルスRNAを1個ずつ識別し、検体中の個数を全自動で定量することができます(図2A)。検出感度は1.4コピー/マイクロリットル(1,000分の1mL)であり、従来のSATORI法の1,400倍に達しました。この感度は、PCR検査法と同等で、COVID-19の診断に十分です。また、1塩基単位の変異を識別する技術も併せて開発し、COVID-19臨床検体を用いた検証実験では、陽性判定、変異株判定において、98%以上の正解率を達成しました(図2C, D)。
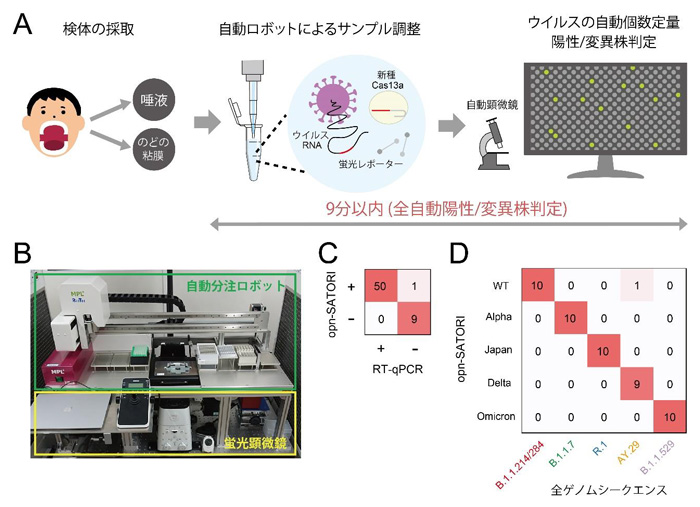
図2 opn-SATORI装置による全自動COVID-19感染診断 (A) 感染診断の模式図。サンプル調製、顕微鏡観察、ウイルスの個数定量、陽性/変異株判定のすべての工程が自動化され、9分以内で完結できる。 (B) opn-SATORI装置写真。 (C)(D) 臨床検体を用いた陽性判定(C)/変異株判定(D)結果。ともに正解率98%以上である。
【今後の期待】
opn-SATORI装置は、ウイルスRNAを「1分子」レベルで識別して世界最高速度で自動定量し、さらには、陽性判定、変異株判定へとつなげることができる革新的なウイルス感染症診断装置です。また、opn-SATORI装置のランニングコストは1検査あたり約2ドルで、PCR検査法や抗原検査法とほぼ同等であるため、安価で素早く多種のウイルス感染症を正確に診断できる次世代の感染症診断装置となることが期待できます(図3)。
また、opn-SATORI装置は、疾患バイオマーカーの検出などにも活用できるため、癌などの基礎疾患の早期・層別化診断などを指向した次世代のリキッドバイオプシー[6]の技術基盤となることも期待できます(図3)。
本研究成果は特許出願済みであり、シスメックス株式会社との社会実装を目指した共同研究を開始しています。
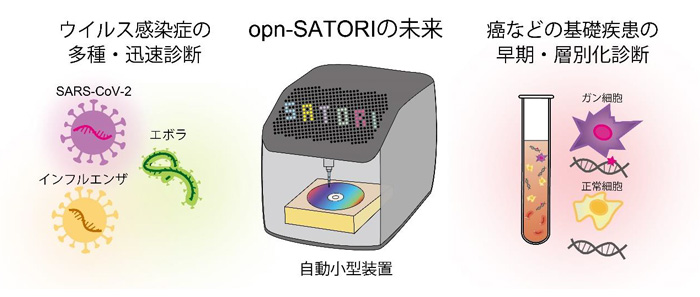
図3 リキッドバイオプシーにおけるopn-SATORI装置の将来展望 ウイルス感染症の多種・迅速診断から癌などの基礎疾患の早期・層別化診断に至る「核酸のデジタル検出」を基盤とした次世代のリキッドバイオプシーのイメージ。
【論文情報】
- <タイトル>
- Automated amplification-free digital RNA detection platform for rapid and sensitive SARS-CoV-2 diagnosis
- <著者名>
- Hajime Shinoda, Tatsuya Iida, Asami Makino, Mami Yoshimura, Junichiro Ishikawa, Jun Ando, Kazue Murai, Yukiko Muramoto, Masahiro Nakano, Kotaro Kiga, Longzhu Cui, Osamu Nureki, Hiroaki Takeuchi, Takeshi Noda, Hiroshi Nishimasu, Rikiya Watanabe
- <雑誌>
- Communications Biology
- <DOI>
- 10.1038/s42003-022-03433-6
【補足説明】
[1] SATORI法
共同研究グループが2021年に開発した、RNAの非増幅・迅速検出法のことである。特定のRNA配列を認識するCas13a酵素と蛍光レポーターの混合液をバイオセンサーとして利用し、標的ウイルスRNAの有無を高感度・高精度・迅速に検出できる。CRISPR-based amplification-free digital RNA detectionの略。
[2] PCR検査法
PCR検査法はポリメラーゼ連鎖反応法(polymerase chain reaction)を用いて新型コロナウイルスを検出する検査法のことである。最初に、増幅対象のDNA、DNA合成酵素(DNAポリメラーゼ)、プライマーと呼ばれるオリゴヌクレオチドを混合して、反応液を作る。反応液を加熱すると、2本鎖DNAが変性して1本鎖DNAになる。次に急速冷却すると、結合(アニーリング)したプライマーの3´端を起点としてDNAポリメラーゼが働き、1本鎖部分と相補的な2本鎖DNAが合成される。これで2倍量のDNAができたことになる。再び高温にしてDNA変性から繰り返す。このように、PCR検査法は、DNA鎖長の違いによる変性とアニーリングの違いを利用して、温度の上下を繰り返すだけでDNA合成を繰り返し、DNAを2倍、4倍、8倍、16倍…と増幅する。
[3] 特異度
検査の性能を表す指標の一つ。陰性のものを正しく陰性と判定した割合。
[4] 核酸切断酵素CRISPR-Cas13a
多くの細菌は、「CRISPR-Casシステム」と呼ばれる獲得免疫システムを備えている。VI型CRISPR-Casシステムに関与するCas13aタンパク質は、ガイドRNAと複合体を形成し、ガイドRNAと相補的な1本鎖RNAと結合すると活性化し、1本鎖RNAを切断するRNA依存性RNA切断酵素である。Cas13a-ガイドRNA複合体をCRISPR-Cas13aと呼ぶ。
[5] 磁気ビーズ
直径1マイクロメートル(1,000分の1mm)程度の磁性ビーズのことである。表面にCRISPR-Cas13a複合体を特異的に結合し濃縮することができる。
[6] リキッドバイオプシー
血液や尿などの身体への負担が少ない低侵襲性の液性検体の解析を基盤とした基礎疾患・感染症の診断方法。
【共同研究グループ】
<理化学研究所 開拓研究本部 渡邉分子生理学研究室>
- 主任研究員 渡邉 力也 (ワタナベ・リキヤ)
- 研究員 篠田 肇 (シノダ・ハジメ)
- 研究員 安藤 潤 (アンドウ・ジュン)
- テクニカルスタッフI 飯田 龍也 (イイダ・タツヤ)
- テクニカルスタッフI 牧野 麻美 (マキノ・アサミ)
- テクニカルスタッフI 吉村 麻実 (ヨシムラ・マミ)
<東京大学 先端科学技術研究センター>
- 教授 西増 弘志 (ニシマス・ヒロシ)
- 大学院生 石川 潤一郎(イシカワ・ジュンイチロウ)
<東京大学 大学院理学系研究科>
- 教授 濡木 理 (ヌレキ・オサム)
<京都大学 医生物学研究所>
- 教授 野田 岳志 (ノダ・タケシ)
- 助教 中野 雅博 (ナカノ・マサヒロ)
- 助教 村本 裕紀子(ムラモト・ユキコ)
<東京医科歯科大学 大学院医歯学総合研究科>
- 准教授 武内 寛明 (タケウチ・ヒロアキ)
<自治医科大学 医学部>
- 教授 崔 龍洙 (サイ・リュウシュ)
<国立感染症研究所 治療薬・ワクチン開発研究センター>
- 室長 氣駕 恒太朗(キガ・コウタロウ)
<株式会社富士フイルム メディアクレスト>
杉山 勝美 (スギヤマ・カツミ)
【研究支援】
本研究は、科学技術振興機構(JST)戦略的創造研究推進事業CREST「細胞外微粒子に起因する生命現象の解明とその制御に向けた基盤技術の創出(JPMJCR19H5)」、三菱財団自然科学研究特別助成「新型コロナウイルス等感染症に関する学術研究助成」、日本学術振興会(JSPS)科学研究費補助金学術変革領域研究(A)「未開拓タンパク質の1分子計測技術・デバイス開発(研究代表者:渡邉力也)」、基盤研究(A)「デジタル検出技術を基盤としたウイルスの新規感染診断法の開発(研究代表者:渡邉力也)」、日本医療研究開発機構(AMED)ウイルス等感染症対策技術開発事業(20he0622032h0001)、新興・再興感染症に対する革新的医薬品等開発推進研究事業(20fk0108529h0001)、バイオテック株式会社「次世代のリキッドバイオプシーへの研究支援」をはじめとする諸機関からの支援によって行われました。
原文URL:https://www.rcast.u-tokyo.ac.jp/ja/news/release/20220526_1.html
