【本研究成果のポイント】
- ゲノム変異、遺伝子発現、DNAメチル化などの統合ゲノム解析によって、肝芽腫(HB)には性質が異なるいくつかのサブグループ(図3のE1-E4)が存在することがわかりました。
- 乳幼児に多くみられる典型的な肝芽腫(HB)では、腸管上皮の幹細胞で重要な転写因子であるASCL2の遺伝子発現が脱メチル化によって亢進していることがわかりました。
- 肝芽腫(HB)症例の予後予測に有用である新しいメチル化マーカーを見出しました。
【概要】
肝芽腫(HB)は、小児に発生する肝臓がんの約80%を占めていて一部に成人型肝細胞癌(HCC)がありますが、その発症機序は未だに十分に解明されていませんでした。
今回、広島大学自然科学研究支援開発センターの檜山英三教授と大学病院小児外科のグループは、東京大学先端科学技術研究センターの油谷浩幸名誉教授(シニアリサーチフェロー)、永江玄太特任准教授および理化学研究所 生命医科学研究センターの中川英刀チームリーダーらとの共同研究により、日本小児肝癌スタディグループ(JPLT、現日本小児がんグループ肝腫瘍委員会) 注1で行ってきた全国多施設共同臨床試験JPLT-2試験に登録され治療された小児肝腫瘍のうち同意を得て治療開始する前の検体163例(肝芽腫154例、肝細胞癌9例)を用いて、がん組織の遺伝子全体の変異や変化を検索しました。
その結果、(1)腫瘍に生じている変異は、診断時年齢とともに増加していました。(2)βカテニンの遺伝子変異注2は高頻度に認められましたが、細胞不死化に関連するTERTプロモーター注3領域の遺伝子変異は、8歳以上の成人型肝細胞癌に近い肝芽腫(TLCT)に多くみられました。(3)乳幼児の典型的肝芽腫では、腸管上皮の幹細胞で重要なASCL2の高発現と胎児の肝臓にみられる増殖因子IGF2(インスリン様成長因子-2)の活性化がみられ、肝芽腫は腸上皮細胞と同様に増殖が活発な未熟な肝芽細胞に由来することを示していました(図1、図2)。(4)病期や進展度などの従来からの予後予測因子とは独立して、新たな予後予測に有用なメチル化マーカーDLX6-AS1を見出しました。
今回の研究結果は、小児肝がん(肝芽腫)の発がんに関わる重要な遺伝子を明らかにし、肝芽腫症例の診断や予後予測の重要な指標となることが期待されます。
本研究成果は、国際雑誌「Nature Communications」(9月20日付)に掲載されます。
【論文情報】
論文名:Genetic and epigenetic basis of hepatoblastoma diversity
著者:Genta Nagae, Shogo Yamamoto, Masashi Fujita, Takanori Fujita1, Aya Nonaka, Takayoshi Umeda, Shiro Fukuda, Kenji Tatsuno, Kazuhiro Maejima, Akimasa Hayashi , Sho Kurihara, Masato Kojima, Tomoro Hishiki, Kenichiro Watanabe, Kohmei Ida, Michihiro Yano, Yoko Hiyama, Yukichi Tanaka, Takeru Inoue, Hiroki Ueda, Hidewaki Nakagawa, Hiroyuki Aburatani, Eiso Hiyama雑誌名:Nature Communications
DOI:10.1038/s41467-021-25430-9.
【背景】
肝芽腫は、小児の肝臓に発生するがんで、多くは5才未満でみられるものが多く、成人にみられる肝細胞癌と異なっています。すなわち、低出生体重児に多く発症し、化学療法も効果がある腫瘍が多く、全国あるいは国際共同の臨床試験にて治療成績が向上してきていますが、中には予後不良の症例もみられます。特に、年長児や思春期にみられる成人型肝がんとの移行型(TLCT)の予後は不良で、その発症要因や予後に関わる因子については未だに明らかになっていません。
本研究では、全国の小児肝がんを診療する施設による多施設共同臨床試験JPLT-2プロトコールで治療した症例のうち、同意のもとに提供された治療開始前検体を用いて、次世代シークエンサーやマイクロアレイなどの大規模なゲノム解析により、世界で初めて治療前肝芽腫検体の遺伝子遺伝子の変異や遺伝子の発現機序を検討しました。
【研究成果の内容】
本研究では、肝芽腫の発生とその進展に関わる遺伝子変異や遺伝子発現などを明らかにするため、未治療の状況で採取された腫瘍検体(診断時の生検、あるいは診断時肝切除)163例(肝芽腫154例、肝細胞癌9例)を用いて、統合的にゲノム注4・エピゲノム注5プロファイリング注6を行いました。その結果、腫瘍に生じている変異は非常に少ないものの(1Mbあたり0.52個)、診断時年齢が増加するとともに変異の数は増加していました。最も頻度の高い体細胞ゲノム変異として約8割の症例にWnt注7経路の活性化に重要なCTNNB1遺伝子に部分欠失または点突然変異を認め、この変異がみられない症例では家族性大腸ポリポーシスの原因となるAPC遺伝子の生殖細胞系列変異が多くみられました。8才以上で診断された成人の肝細胞癌に類似した病理所見を示す成人型肝細胞癌との移行型(TLCT、図3のE1グループ)では、細胞の不死化に関わっているTERTという遺伝子を活性化する部位(プロモーター領域)に変異が認められ、成人型の肝細胞癌と共通していました(図2)。
肝芽腫と正常肝組織の遺伝子発現を調節しているエンハンサー注8領域のメチル化パターンから4つのグループ(図3のE1からE4)に分類されました。Wnt経路の解析をすすめると、腸管にある幹細胞の分裂を調節転写因子として知られるASCL2遺伝子を活性化する特異的なエンハンサー領域の低メチル化が明らかとなり、実際の肝芽腫の組織にASCL2が発現していることを確認しました(図3)。
さらに、治療成績との関連した因子を検討した結果、通常の臨床で用いられている予後予測因子と独立して、予後予測に有用なメチル化マーカーDLX6-AS1を新たに見出しました。
【今後の展開】
本研究の成果は、全国共同臨床試験において収集された世界最大規模の症例のゲノム解析を行うことで、小児肝がん(肝芽腫)の起源や成因を理解するための手がかりを与えるのみならず、肝芽腫の臨床的な予後予測や有効な薬剤開発のための治療標的を見出す重要な所見となることが期待されます。
【本研究への支援】
この研究は平成26年度から始まった厚生労働省『革新的がん医療実用化研究事業』(平成27年度から日本医療研究開発機構へ移管)およびAMED『次世代がん研究シーズ戦略的育成プログラム(P-DIRECT)』、『次世代がん医療創生研究事業(P-CREATE)』及びMEXT 文部科学省科学研究費などの支援のもとで行われました。
【参考資料】
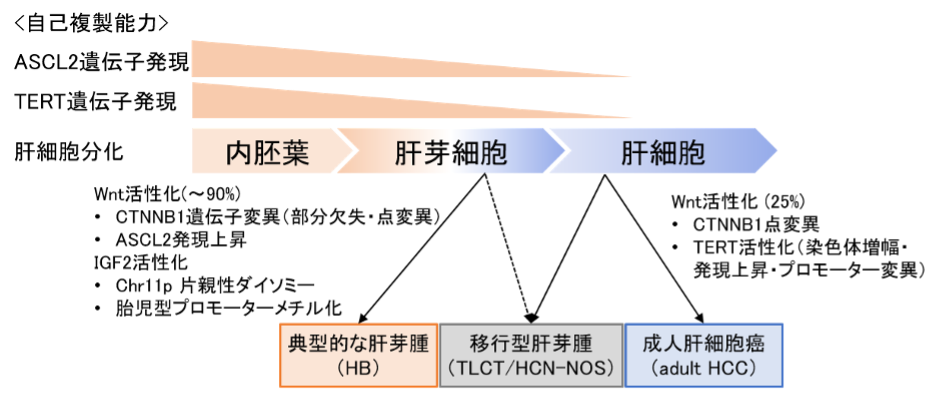
図1:小児肝がんの発生機序
小児に発生する肝芽腫(図3のE2, E3, E4)では、CTNNB1遺伝子変異やエンハンサーの脱メチル化によるASCL2上昇などのWnt経路とIGF2増殖因子の活性化が生じていて、思春期にみられる移行型(E1)では成人肝細胞癌に時にみられるTERTのプロモーター変異が生じていた。
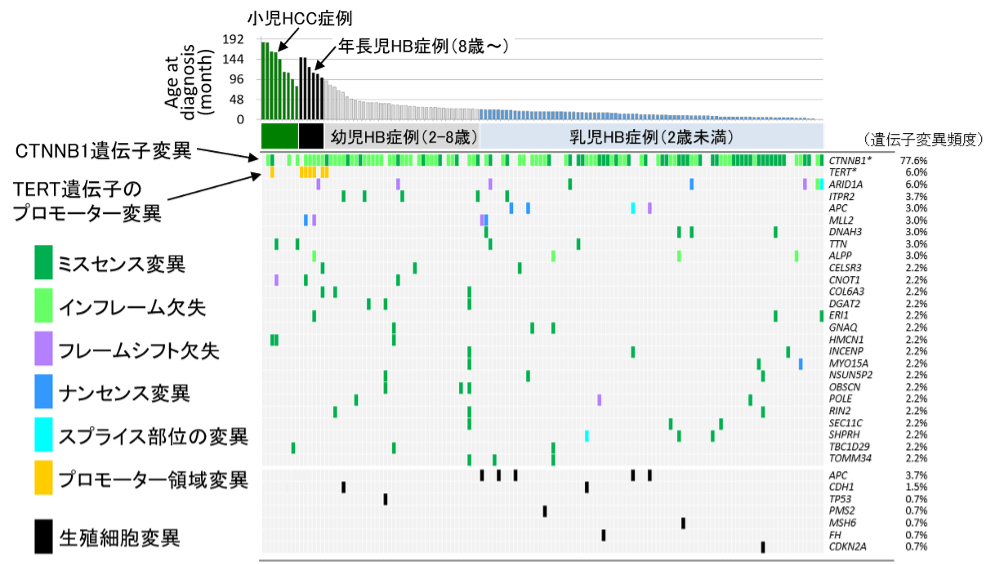
図2:小児肝がん検体の遺伝子変異の頻度:
CTNNB1遺伝子変異が高率に認められ、乳幼児HB(図3のE3、E4)にCTNNB1のミスセンス変異がやや多かった8歳以上の年長児にみられるHB(E1)にTERT遺伝子のプロモーターに変異が認められた。他の遺伝子変異は6%以下で、成人癌に比べ変異の頻度は極めて少なかった。(ミスセンス変異: 3つの塩基によるコドンの読み枠が変化してアミノ酸が変化する変異、フレームシフト変異:1塩基の欠失や挿入、重複によって、コドンの読み枠が変化する変異、インフレーム変異:3の倍数の欠失や挿入でコドンの読み枠(アミノ酸)が変化しない変異、ナンセンス変異:コドンの読み枠が終止コドンとなる変異、スプライシング変異:アミノ酸配列をコードしているDNA配列(エクソン)のつなぎ目の変異、プロモーター領域の変異:遺伝子発現を調節するプロモーター(注2)領域の変異、胚細胞変異:個体のもとになる胚細胞にすでに生じている変異
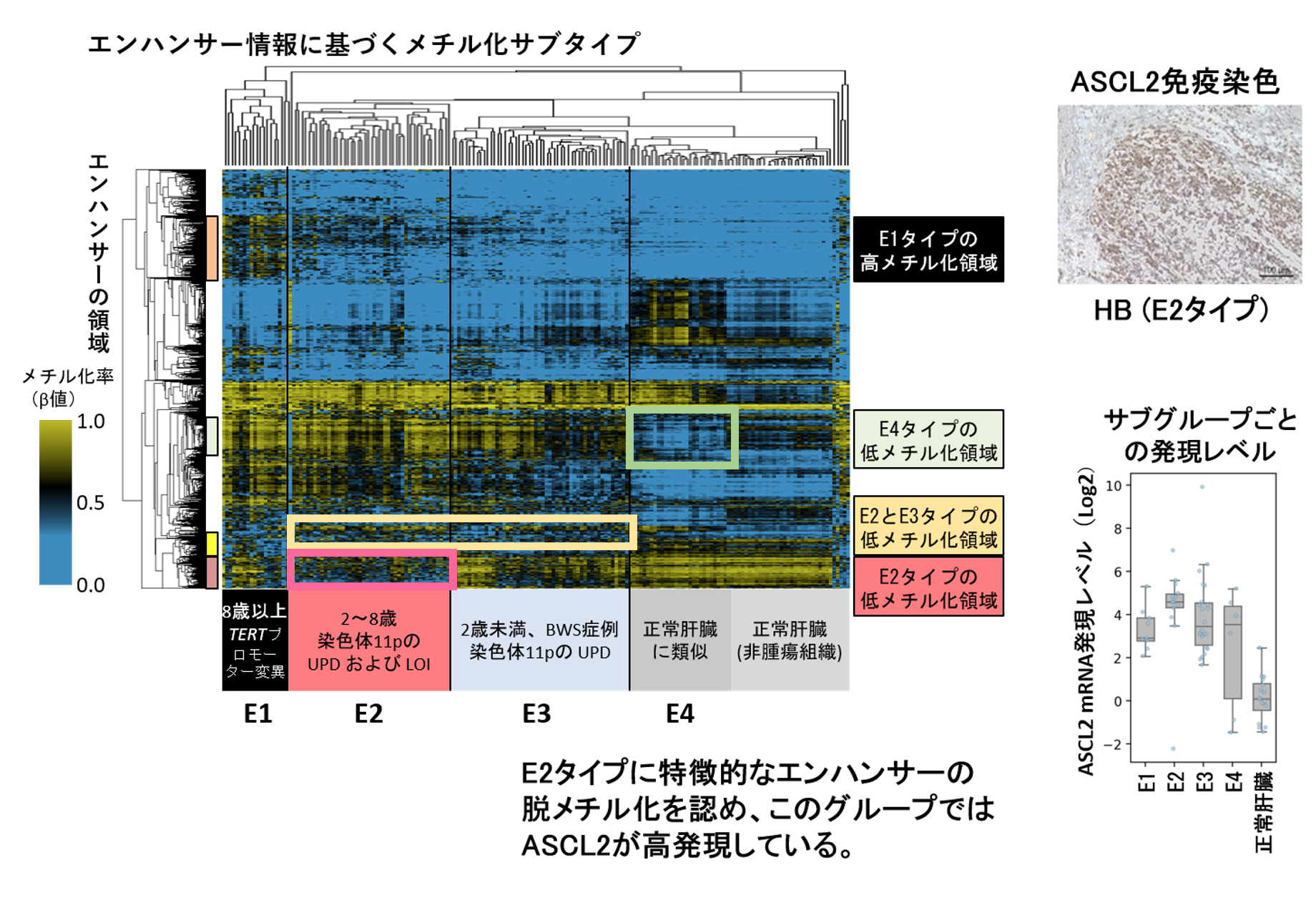
図3:小児肝がん検体のエンハンサー領域のメチル化による層別(左)と
ASCL2遺伝子発現(右)
肝芽腫と正常肝組織の遺伝子発現を調節しているエンハンサー領域のメチル化の程度からグループ分けすると、思春期に多いTLCT型(E1)、小児型(E2)、乳児型(E3)、正常肝に類似した型(E4)の4グループに分けられた。腸管の幹細胞で発現しているASCL2は肝芽腫組織で発現しており、エンハンサー領域の脱メチル化によるものと考えられた。
【用語解説】
注1:日本小児肝癌スタディグループ(JPLT、現日本小児がんグループ肝腫瘍委員会)
小児の肝癌特に肝芽腫と肝細胞癌の治療成績を向上させるために、世界に先駆けて1989年に設立された全国多施設共同研究を行う研究グループで、JPLT-2はその2番目の臨床試験で、シスプラチンとピラルビシンという治療薬の組み合わせを主体とした試験が全国130余りの施設で施行された。現在は、他の小児がんのグループと合併し日本小児がんグループとしてその後のJPLT-3, JPLT4の国際共同試験を行っている。URL: https://home.hiroshima-u.ac.jp/eiso/
注2:遺伝子変異
特定の遺伝子の配列が一部入れ替わったり、欠落したりする変化を示します。本研究では、βカテニン遺伝子のエクソン3の領域に配列の入れ替わりや、欠落が多数認められましたが、配列の入れ替わり(点突然変異)や3塩基の欠落(部分欠失)によってアミノ酸配列が変化し、βカテニンのタンパクが恒常的に活性化した状態に変化します。体を構成するすべての細胞にみられる先天的なDNAの変異を生殖細胞変異、生殖細胞以外の細胞に生じた後天的なDNAの変異を体細胞変異といいます。
注3:プロモーター
DNAからRNAへの転写の開始に関与する遺伝子の上流領域を指し、このプロモーター領域に転写因子(特定のタンパク質など)が結合して転写がはじまります。その部位にメチル化が生じたりすると転写因子が結合できなくて転写がはじまらないなど、転写の調節に重要とされる領域です。
注4:ゲノム
細胞に含まれる遺伝情報の全体の1セットを指し、通常の細胞(生殖細胞を除く)では、2組のゲノムが存在することになります。
注5:エピゲノム
ゲノムDNAの配列を変化させることなく、RNAの転写を制御することを指し、ゲノムDNAやヒストンなどの可逆的な化学修飾(メチル化など)を行う仕組みを指します。
注6:プロファイリング
遺伝子変化や遺伝子発現、遺伝子修飾について、同時に100以上の多数の遺伝子を調べて変化のあるものを見出すことをプロファイリングといい、ゲノム全体の変異をみたり、エビゲノムによるメチル化修飾などを見ることを指します。本研究では、遺伝子変異、遺伝子発現、遺伝子修飾のプロファイリングを行い、これらの関係も検討したので統合的としました。
注7:Wnt経路
個体が発生するときやがんの発生に関連して発現してくるタンパク質のネットワークの一つで線虫からヒトまで広く存在していて、ショウジョウバエではこの経路の遺伝子が壊れると羽のない形似ることで有名です。ヒトの肝細胞癌や肝芽腫でこの経路の異常があることは既にしられています。
注8:エンハンサー
特定の遺伝子のRNAへの転写を高めるためにタンパク質(転写因子)が結合する短い(50–1500塩基対)DNA領域です。プロモーター領域の近くだけでなく、かなり離れた領域にも存在しています。ヒトゲノムには数十万個のエンハンサーが存在し、さまざまな異なる細胞での遺伝子発現制御に関わっていることがわかっています。
原文URL:https://www.rcast.u-tokyo.ac.jp/ja/news/release/20210920.html
