計量生物医学分野、浜窪隆雄教授と、増田一之助教、井原茂男教授らは三量体Gタンパク質からのシグナルを可視化し計量解析する論文を発表しました。
Visualization of ligand-induced Gi protein activation in chemotaxing cells.
Kazuyuki Masuda, Jun-ichi Kitakami, Tohru Kozasa, Tatsuhiko Kodama, Sigeo Ihara and Takao Hamakubo
FASEB J. Published online before print November 23, 2016, doi: 10.1096/fj.201601102R
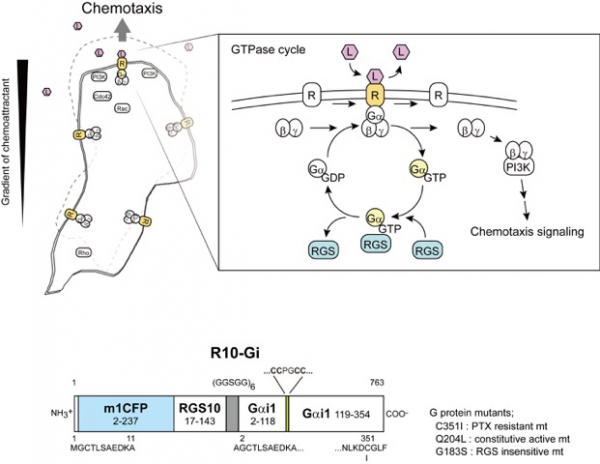
細胞走化性は細胞の生理的応答の他、炎症反応やガンの浸潤など多くの病態に関わる現象です。Gタンパク質共役型受容体(GPCR)を介した走化性は、細胞外の走化性因子がGPCRと特異的に結合し、細胞内の三量体Gタンパク質を活性化することにより引き起こされます。さらに三量体Gタンパク質によって、細胞内のシグナル伝達下流の分子群が順次活性化されていくことが明らかになっています。これまで走化性のメカニズムは、シグナル下流の分子の活性制御について蛍光イメージング等により積極的に調べられてきました。一方、走化性シグナルの上流である受容体や三量体Gタンパク質の活性の変化について、動的に形状変化する細胞での直接の観察が困難であったため、多くの不明な点がありました。細胞外の走化性因子のわずかな濃度の違いが細胞にどのように感知されているのか明らかにするため、とくに細胞走化時における三量体Gタンパク質の局所的な活性変化の可視化による検証が期待されてきました。
今回我々は、三量体Gタンパク質の活性を検出するために蛍光共鳴エネルギー移動(FRET)を利用した新規の分子プローブ(R10-Gi FRETプローブ)を開発しました。開発したR10-Gi FRETプローブはGi共役型のGPCRと共役し、リガンド刺激依存的なGタンパク質活性化を示しました。またGタンパク質活性化に伴うFRETシグナルの上昇を示しました。
ヒト白血病由来HL-60細胞は、好中球様に分化すると走化性因子のロイコトリエンB4(LTB4)に特異的な受容体(BLT1)発現し、LTB4の濃度勾配に従った走化性を示します。我々はR10-Gi FRETプローブを用いることにより、好中球様HL-60細胞のLTB4への走化時の三量体Gタンパク質活性変化の測定が可能であることを見出だしました。また好中球様HL-60細胞の測定から、細胞の走化方向での三量体Gタンパク質活性化は、これまで考えられていたよりも局所的な領域で起こることが明らかになりました。今回開発したR10-Gi FRETプローブは、これまでの分子プローブよりも動的に形状変化する細胞でのシグナル測定に優れていると考えられ、今後様々な研究への応用が期待されます。